προηγούμενο:Υδροστατική ισορροπία
ενότητα:Στοιχεία της
ατμόσφαιρας
Ο ορισμός της ειδικής θερμότητος c δίνεται από την έκφραση:
![]()
όπου q είναι η θερμότητα ανά gm η όποια
εισέρχεται στο σύστημα και c είναι η απαιτούμενη
θερμότητα για να αυξηθεί η θερμοκρασία ενός gm του
συστήματος κατά 1 K. Yπο συνθήκες σταθερού όγκου v
o οποίος ορίζεται από v = V/M = RT/p
έχομε ![]() όπου V
είναι ο ολικός όγκος του συστήματος, Μ η ολική
μάζα, R είναι η σταθερά του αέριου που
αποτελεί το σύστημα, και p είναι η πίεση του
αερίου. Βλέπομε ότι το v είναι ίσο προς 1/ρ,
όπου ρ είναι η πυκνότητα μάζας. Υπο συνθήκες
σταθερής πίεσης έχομε
όπου V
είναι ο ολικός όγκος του συστήματος, Μ η ολική
μάζα, R είναι η σταθερά του αέριου που
αποτελεί το σύστημα, και p είναι η πίεση του
αερίου. Βλέπομε ότι το v είναι ίσο προς 1/ρ,
όπου ρ είναι η πυκνότητα μάζας. Υπο συνθήκες
σταθερής πίεσης έχομε ![]() =
= ![]() . H
εισερχομένη θερμότητα q (erg/gm) δίνεται από μια άλλη
έκφραση του πρώτου νόμου της θερμοδυναμικής:
. H
εισερχομένη θερμότητα q (erg/gm) δίνεται από μια άλλη
έκφραση του πρώτου νόμου της θερμοδυναμικής:
![]()
όπου e είναι η εσωτερική ενέργεια του συστήματος που είναι συνάρτηση της θερμοκρασίας, δηλαδή, e=e(T). Aντικαθιστώντας το dq από το de+pdv βρίσκομε:
![]()
και
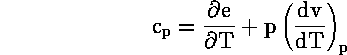
άρα
![]()
H εσωτερική ενέργεια e(T) έχει τις ακόλουθες συνιστώσες:
![]()
όπου:
ενέργεια μοριακής ταλαντώσεως
![]() ενέργεια μοριακής περιστροφής
ενέργεια μοριακής περιστροφής
![]() ενέργεια μοριακής μεταφοράς
ενέργεια μοριακής μεταφοράς
![]() ενέργεια μοριακής ηλεκτρονικής δομής
ενέργεια μοριακής ηλεκτρονικής δομής
Η εσωτερική ενέργεια ταλαντώσεως και ηλεκτρονικής δομής είναι σημαντικές μόνο σε υψηλές θερμοκρασίες ( >1000 K), ενώ για μονοατομικά μόρια δεν υπάρχει εσωτερική ενέργεια ταλαντώσεως. H εσωτερική ενέργεια e(T) μπορεί να προσεγγιστεί ως:
![]()
Για κάθε βαθμό ελευθερίας έχομε ![]() RT εσωτερική ενέργεια.
Ετσι για κινηση στις τρείς διαστάσεις έχομε
RT εσωτερική ενέργεια.
Ετσι για κινηση στις τρείς διαστάσεις έχομε ![]() RT. Γενικά ένα
μόριο έχει τρείς άξονες περιστροφής, αλλά όταν το
μόριο είναι γραμμικό τότε μπορεί να περιστροφεί
μόνο γύρω από τους δύο, η περιστροφή γύρω από τον
άξονα όπου συνδέονται τα άτομα του μορίου δεν
συνεισφέρει. Ετσι για γραμμικά μόρια e(Τ)=
RT. Γενικά ένα
μόριο έχει τρείς άξονες περιστροφής, αλλά όταν το
μόριο είναι γραμμικό τότε μπορεί να περιστροφεί
μόνο γύρω από τους δύο, η περιστροφή γύρω από τον
άξονα όπου συνδέονται τα άτομα του μορίου δεν
συνεισφέρει. Ετσι για γραμμικά μόρια e(Τ)= ![]() RT και για μη
γραμμικά μόρια e(Τ)=
RT και για μη
γραμμικά μόρια e(Τ)= ![]() RT. Η ειδική θερμότητα
RT. Η ειδική θερμότητα ![]() =
= ![]() R για τα γραμμικά μόρια
R για τα γραμμικά μόρια ![]()
![]() και
και ![]() ενώ για το μη γραμμικό
μόριο
ενώ για το μη γραμμικό
μόριο ![]() το
το ![]() =4R.
=4R.
προηγούμενο:Υδροστατική ισορροπία
ενότητα:Στοιχεία της ατμόσφαιρας